锂电池开发史(五):锂电池事故原因大多为过充电
2015-03-20 09:17:48 日经BP 过充电是二次电池的大敌
什么才叫正确使用电池?最重要的是避免过充电。微量的过充电也有可能导致冒烟和着火等事故。比如说,FUJITSU TECHNO RESEARCH曾对4.25V和4.30V电压下充电的LIB分别进行了“挤压测试”和“穿钉测试”(图1)。结果,4.25V充电的LIB没有出现问题,而4.30V充电的LIB出现了冒烟和着火。区区50mV的差别,就有可能酿成重大事故。
 |
| 图1:电池燃烧的一大原因在于过充电 充电电压仅相差50mV左右,电池就会发生燃烧(a,b)。(摄影:FUJITSU TECHNO RESEARCH) (点击放大) |
过充电导致事故的危险性不仅存在于LIB,还存在于所有二次电池。比如说安全性远高于LIB的Ni-Cd(镍镉)二次电池。电解液使用水溶液,正极和负极分别使用镍(Ni)和镉(Cd)的化合物。没有任何着火要素。尽管如此,这种电池依然会因过充电而处于危险状态。
Ni-Cd二次电池充满后,正极将产生氧气,负极将产生氢气。一旦混合形成氧气与氢气体积比为1:2“爆鸣气”,在遇到某些诱因的时候,很容易发生爆炸。
为防止这种现象发生,Ni-Cd二次电池通过改良,在负极采用了超过必需量的镉化合物。如此一来,在充电快要结束的时候,正极将先行充满并产生氧气,而负极还存在未充电的部分,将继续充电。正极产生的氧气移动到负极,与负极充电完成部分的金属镉发生反应。反应后的金属镉回到未充电状态。这使得负极总是存在未充电的部分,能够不断消耗正极输送来的氧气。
这个方法看似万无一失,其实也存在弱点。在低温下,吸氧反应的反应速度慢,镉负极的吸氧反应将受到抑制。氧气发生与吸收的平衡一旦打破,负极将达到充满状态并产生氢气,从而形成爆鸣气。这种情况容易在快速充电等使用大电流充电时发生。
过充电为什么危险?
对于LIB,过充电造成的影响更严重。原因在于过充电会造成两个大问题。一个是超过负极锂容量(理论容量,石墨为372mAh/g)的锂将转化为金属锂,以枝晶状析出。这有可能造成内部短路。
另一个是正极会产生反应性非常强的氧气。如果氧气与LIB内的电解液、锂和碳的化合物结合,也就是发生氧化反应,可能会导致发热和着火。
下面以正极的代表性物质钴酸锂(LiCoO2)为例,来详细解释一下其中的原因。LiCoO2的结构是在氧化钴(CoO2)层之间插入锂。充电时,锂将脱离正极,向负极移动。锂脱离后,“空房子”(空隙)将会增加。钴(Co)会趁虚而入,钻进这些“空房子”寄住。随着充电的进行,“空房子”越多,或是温度越高,钴越容易发生移动。钴移动到锂曾经的地盘后,之前与钴组成CoO2的氧将失去伙伴,也从正极脱离。
这些氧是以原子状态单独存在的“初生态氧”,反应性非常强,与任何物质都很容易发生反应注1)。LIB中含有容易氧化的电解液、锂和碳的化合物,这些物质会与氧结合,导致发热和着火。
注1)空气中的氧是原子结合形成的氧气(02)(键位占满),反应性不强。如果反应性强,生物在呼吸时,肺就会与氧气发生反应并灼伤,无法生存。我们必须感谢氧气不具备强反应性。
“初生态氧”会在怎样的条件下产生?我们以Li1-xCoO2的x为参数,通过利用热质量分析法检测改变温度时的质量变化,对相关条件进行了研究(图2)。结果显示,x越大,也就是充电进度越大,质量开始减少的温度越低,减少量越大。质量减少是氧脱附的表现。而且我们还发现,充电进度越大(x越大),脱附的氧越多,氧脱附发生的温度越低。也就是说,要想抑制“初生态氧”产生,不在超过规定的电压下充电(避免过充电)、电池不升温注2)是必需条件。为满足这些条件,组装企业等LIB的使用者必须小心谨慎。
注2)在合成LiCoO2时添加铝(Al)和镁(Mg)也是抑制初生态氧产生的有效手段。添加这些物质后,氧脱附温度将升高,在一定程度上可以遏制脱附反应。
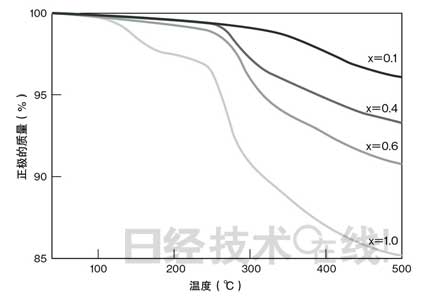 |
| 图2:充电进度越大,正极质量越小 通过Li1-xCoO2的x的差异表示正极的质量变化。x越大表示充电进度越大。随着氧脱附的进行,正极质量变小。 (点击放大) |
快速充电是造成过充电的原因
容易发生过充电的情况主要有两种:快速充电时、电池单元失衡时。先来看快速充电。
LIB推荐采用恒定电流/恒定电压(CC/CV:constant current/constant voltage)充电。这是先在恒定电流下充电(CC充电),当达到规定电压后,切换至恒定电压充电(CV充电)的方法(图3)。通常的LIB在开始充电时,充电电压为4.2V,电流为1C注3)。因为电流为1C,所以在理论上,1个小时后,端电压将达到4.2V。但充电电压与端电压之间,存在叫作“过压”*的偏差。因此,当充电电压达到4.2V时,实际的端电压低于4.2V。
注3)以1C充电是指以理论上可1小时充满的电流充电。电池容量为2000mAh时,1C为2000mA。5C充电则是以1C的5倍,也就是1万mA的电流充电。
*过压=电极反应产生电流时,电极电位会偏离平衡电位。这个偏移叫作过压。比如说,在进行电解时,加载的电压不高于理论电压,就不会发生电解。对电池来说,实际的电池电压低于由正极、电解液、负极的组合决定的理论电压。
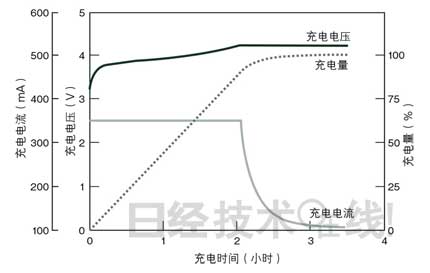 |
| 图3:恒定电流/恒定电压充电(CC/CV)的情况 LIB推荐采用以恒定电流开始充电,在达到规定电压后,切换至恒定电压充电的CC/CV充电。 (点击放大) |
这就是说,充电电压达到4.2V时,电池没有充满,充电量仅为70~80%左右。要想继续充满,需要切换到CV充电,在维持4.2V的充电电压的同时,慢慢补充剩余的20~30%。不过,在CV充电时,电流会缩小,如果为缩短充电时间,扩大CC充电时的电流值,过压的偏移将会增大,使充电电压提前达到4.2V。电池可能会需要更长的时间才能充满。
如果只需充入70~80%的电量,通过在CC充电时进行大电流快速充电,20~30分钟即可完成。但是,要想利用CC充入接近100%的电量,则有些不切实际。因为达到这个目的需要的电压高于4.2V的规定电压,会形成“快速充电=过充电”的等式。
设置保护电路应对单元失衡
最近有一种思路:即使充电电压超过规定电压,只要采用脉冲充电的方式,借助电流的中断,就不会造成过充电。但脉冲充电的暂停时间意味着脉冲电流要大于连续充电的电流。虽然充电快,但必须加载高于规定值的电压,依然会造成过充电。大家千万不要误会。
造成过充电的另一个因素是电池组电池单元性能的失衡。下面以两个单元串联而成的简单电池组为例进行介绍。
假设两个单元中的一个劣化严重,容量出现失衡。如果在这种状态下为两个单元充电,容量劣化的单元将提前达到充满状态。假设一方的电压为4.2V,另一方为3.8V。此时,充电电压为4.2V的2倍,也就是8.4V,按照简单推算,充电结束时,一个单元的电压为4.4V,另一个为4.0V。4.4V的单元明显处于过充电状态。
避免失衡导致过充电的方法,是在外部设置保护电路,在单元电压达到4.2V时停止充电。但是,如果单元数量多,采用这种方法需要设置大量的FET,用来监控电压,在成本上并不划算。
对氧化还原对材料寄予期望
不依赖保护电路等装置,使电池自身能够防范过充电的材料一直没有停下开发的脚步。虽然尚未投入实用,但作为此类材料的代表,氧化还原对材料的前景备受看好。材料的作用机制不难解释,已经得到了Ni-Cd二次电池和镍氢二次电池的采用。
关于Ni-Cd二次电池的过充电问题,前面已经说过,在充满电时,正极将产生氧,产生的氧将被负极消耗。换句话来说,就是正极产生(氧化反应)的氧在负极消耗(还原反应),这个过程耗时漫长。在充电时,电池处于下面的循环状态。
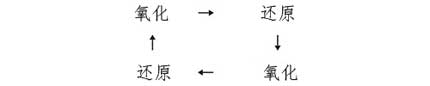 |
也就是说,只要形成这样的循环,就能制造出不会出现过充电的电池。这叫作氧化还原对反应。氧化还原(Redox)包括还原(Reduction)与氧化(Oxidation)两个步骤。
LIB不能像Ni-Cd二次电池那样,直接赋予其氧化还原对功能。这是因为在充电时如果不控制电压,正极的Li+(锂离子)将源源不断地被运往负极。LIB发生氧化还原对反应必须另行采用具备该功能的材料。这已经成为了电池开发人员长年面对的课题。
采用由具备氧化还原对功能的单元组成的电池组可以解决电池单元失衡的问题(图4)。当某个特定单元提前充满后,该单元的氧化还原对功能将启动,停止为电极充电。而未充满的其他单元的氧化还原对功能不启动,继续进行充电。
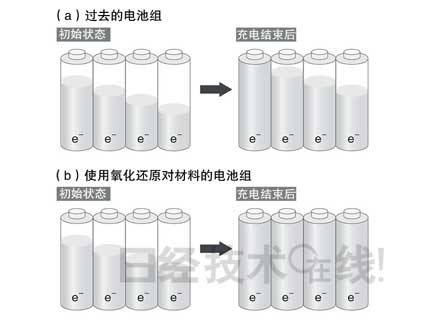 |
| 图4:使用氧化还原对材料可以解决电压的不均 过去的电池组在单元失衡的状态下停止充电的情况(a),使用氧化还原对材料的电池组可以使所有单元达到相同电压(b)。图片根据3M公司的论文制作。 (点击放大) |
笔者的研究室曾在大约25年前尝试开发过氧化还原对材料。我们当时尝试的材料只能在非常小的电流下产生氧化还原对反应,应付不了通常的充电电流。
近年来,随着仿真技术的进步,人们对于什么结构的化合物会发生氧化还原对反应已经有了一定的了解。2008年,美国3M公司开发出在3.9V的电压下工作的氧化还原对材料,使实用化带上了一丝现实色彩(图5)。现在,在4.2V下工作的材料也在研究之中,如果有效,应该可以应用于占据LIB主流的LiCoO2系电池。
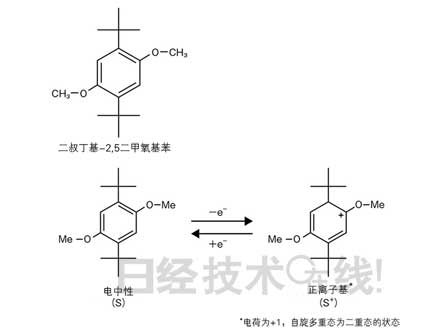 |
| 图5:在3.9V下工作的3M公司的氧化还原对材料 通过反复进行氧化还原反应防止过充电的氧化还原对材料的研究是新一代电池开发的一大焦点。3M公司开发出了在3.9V下工作的材料。图片根据3M公司的论文制作。 (点击放大) |